全血DNA小量试剂盒
适合在15~20分钟内从全血中快速分离纯化基因组DNA
全血标本用量:200~400μl
无需事先分离去除红细胞
无需蛋白酶K消化步骤
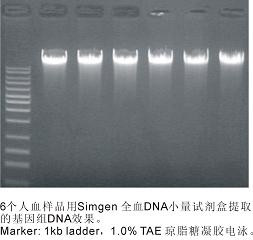
适用于从全血中分离纯化最多达15 μg总DNA。
·15分钟内即可完成血液总DNA的制备。
·无须事先分离去除红细胞及蛋白酶K消化步骤。
·可从新鲜或者是冷冻的全血、溶血的全血、唾液、 细胞悬浮液等标本中分离纯化总DNA。
·核酸纯化柱可最大吸附15μg 总DNA。
·起始样品体积:200 μl- 400 μl全血。
·彻底清除血样中的PCR抑制物,可使用多至1/2反应体系体积的模板进行扩增。
·所需仪器:可适合2 ml离心管使用的离心机。
产品原理
全血样品经裂解液溶解后,用沉淀液沉淀血红蛋白。柱纯化核酸技术过滤除去残留的血红蛋白,吸附在纯化柱上的总DNA经Buffer WA和Buffer WB洗涤后,可彻底清除残留在纯化柱上的杂质及PCR抑制物。纯化柱上的总DNA可直接用BufferTE或水洗脱,并可立即用于各种分子生物学实验。
操作步骤
在400 μl全血中加入300 μl Buffer L1溶解全血释放DNA,再加入300μl Buff
er L2沉淀血红蛋白,离心取上清加入纯化柱中,经过结合、清洗步骤去除残留的杂质后,DNA即可被TE溶液洗脱下来。
可适用的分子生物学实验

1.PCR
2.RFLP分析
3.Southern blotting
4. 基因分型,包括指纹印迹和亲子鉴定
常见问题分析
1、回收不到DNA或者DNA的回收效率低
可能的原因:
1)Buffer WA 或Buffer WB中未加入无水乙醇,应按比例补加无水乙醇。如果是错误地加入了其他试剂,请向我公司技术部寻求帮助。
2)Buffer WA 或Buffer WB中错误地加入了70%乙醇。请向我公司技术部寻求帮助。
3)错误地使用了Buffer WA 和Buffer WB的洗涤顺序。确保按正确的顺序洗涤纯化柱。
4)全血样品保存不当,导致全血中的DNA降解。在2-8℃冰箱放置超过两个星期的全血标本开始出现溶血现象,如果需要继续使用血样,则应转入-20℃或-70℃冻存。否则获得的DNA将开始出现凋亡细胞的DNA带型,并且此时全血中的DNA随着时间的延长会持续分解,直至分离不到电泳可见的DNA。
5)DNA的洗脱效率差。参考第4页柱纯化技术中的第4点“洗脱DNA“内容优化DNA的洗脱方案。
6)错误地使用了Buffer L1 和Buffer L2的溶解顺序。确保按正确的顺序操作。
2. 纯化柱膜上残留有血色素
可能的原因:
Buffer WA 或Buffer WB中未加入无水乙醇,应按比例补加无水乙醇。
3. 样品间交叉污染
避免样品间交叉污染的方法:
1) 选用含有滤芯的移液器吸头用于实验的操作。
2) 实验操作时勿使吸头触碰到纯化柱。
3) 丢弃滤液后将2ml离心管在纸巾上倒扣拍击一次,以避免粘附在离心管管口的滤液对离心机的污染。
4) 如果手套接触到标本,应及时更换手套。
产品序号:3001050 / 3001250
|